FDA认证 / FDA注册代理
- 參、註冊FDA醫療設備Medical Devices
- 參之壹、我的產品屬於哪一類?
- 參之貳、申請要準備什麼資料? (登記、510K、等等)
- 參之參、申請需要多少時間與費用?
- 參之肆、如何取得DUNS鄧白氏號碼?
- 參之伍、完成後我會得到什麼?
- 參之陸、誰該註冊FDA醫療設備?
- 肆、註冊FDA非處方藥OTC
- 肆之壹、我的產品算是OTC藥品還是化妝品?
- 肆之貳、我的產品可以申請OTC非處方藥嗎?
- 肆之參、申請OTC要準備什麼資料?
- 肆之肆、申請OTC需要多少時間與費用?
- 肆之伍、如何取得DUNS鄧白氏號碼?
- 肆之陸、OTC完成後我會得到什麼?
- 肆之柒、誰該註冊FDA OTC非處方藥?
壹、 FDA的LOGO使用权?
FDA Logo仅供官方使用,任何私自使用可能对大众传递错误讯息,误以为FDA对某件事物的认可。未经授权的使用FDA Logo可能违反联邦法律,承担民事和(或)刑事责任。
The FDA logo is for the official use of the U.S. Food and Drug Administration (FDA) and not for use on private sector materials. To the public, such use would send a message that FDA favors or endorses a private sector organization or the organization’s activities, products, services, and/or personnel (either overtly or tacitly), which FDA does not and cannot do. Unauthorized use of the FDA logo may violate federal law and subject those responsible to civil and/or criminal liability.
原文网址:
https://www.fda.gov/about-fda/website-policies/fda-logo-policy
貳、 FDA注册的证书是真是假?
由于防疫物品需求大增,FDA也特别对”证书”做出声明,我们在这教大家怎么做判断。 坊间的FDA证书,是由代理单位出具的结案声明,好比一张收据,上面描述案件的注册内容。 初次接触的客户容易被误导,因为有些代理公司使用了FDA的Logo,或是千奇百怪的暗示,然而,未经授权的使用FDA Logo可能违反联邦法律,承担民事和(或)刑事责任。 各位只需要看最底下的签属公司,就知道是不是FDA发的啦。
FDA does not issue Registration Certificates to medical device establishments. FDA does not certify registration and listing information for firms that have registered and listed. Registration and Listing does not denote approval or clearance of a firm or their devices.
參、 注册FDA医疗设备Medical Devices
参之壹、我的产品属于哪一类?
意指仪器、器械、工具、机器、配件、植入物、体外试剂或其他类似或相关的物品,该物品是用于诊断、治愈、缓解、治疗或预防人类疾病或动物疾病的设备。
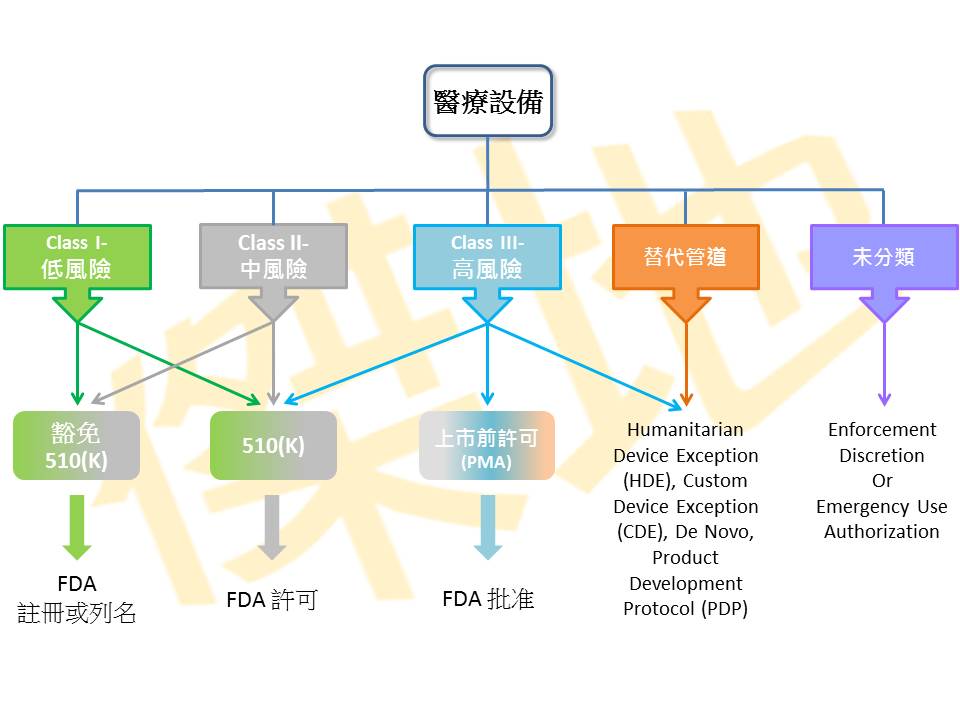
FDA医疗设备所涉及的范围很广,从简单的便盆到复杂的起搏器皆涵盖在内,他们将每一种医疗器械都明确规定其产品分类和管理要求,目前FDA医疗器械产品目录中有上千种。任何一种医疗器械想要进入美国市场,必须先弄清申请上市产品分类和管理要求。根据不同的风险等级,FDA将医疗设备分为Ⅰ类低风险,Ⅱ类中风险及Ⅲ类高风险,风险等级越高,所受的监督越严格。
Class I低风险:危险性小或是没有危险性之产品,这类产品只需实行一般控制(General Control),如:医疗配件、眼镜框、眼镜片、牙刷等..
Class II中风险:除了要符合一般控制外,还需实行特殊控制(Special Control),必须先通过上市前通知(PMN)后,才可进行注册,如:宣称可过滤95%细菌or病毒之N95口罩,医用手套等…
Class III高风险:此分类多为侵入人体或是维持生命之器材,对人体具有潜在的风险,这些器材都必须经过上市前许可(PMA)后才能销售。
参之贰、申请要准备什么资料?
大部分I类设备是实行一般控制(General Control),只需要支付FDA年费,并进行企业注册与产品列名即可于美国上市,但请注意,并非所有I类设备都可以豁免510(K)。
大部分II类设备是实行特殊控制(Special Control),需撰写510(K)审查文件,申请人或公司必须将欲申请上市的医疗设备与已在美国FDA上市之一种或多种相似医材做比对,证明其具有相同的安全性与有效性(=实质等同,Substantial Equivalence,SE),此份文件并没有一定的格式,需有逻辑性且架构清楚的说明。但有少数产品虽为II类,仍可豁免510(K)。
-process.jpg)
需准备的有:
1. FDA医疗设备User Fee
2. 我司注册代理费
3. 邓白氏号码(DUNS Number)
4. 公司注册登记数据
5. 510(K)技术文件
6. FDA 510(K)规费
参之参、申请需要多少时间与费用?
已豁免510(K)之医疗设备,只需要进行注册列名,数据齐全后,申请时间大约1~2周左右即可完成。
而510(K)申请时间大约落在3~8个月不等,要视申请者资料是否齐全与FDA审查而定。
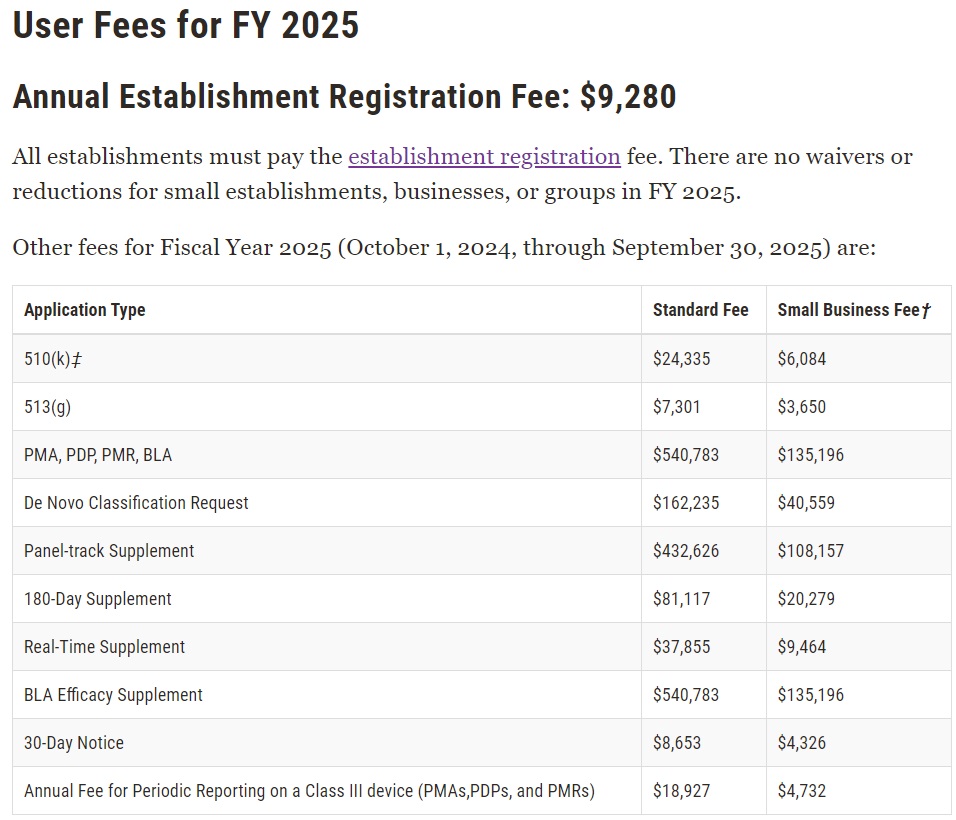
1. FDA 2025医疗设备User Fee USD 9,280
2. 我司注册代理费首年USD 1,600,续约USD 1,000
3. 510(K)费用
(1) FDA 510(K)规费
(a) 标准费用 USD 24,335
(b) 小企业(SBD) USD 6,084(年度营业额小于1亿美金之企业可申请小企业资格)
(2) 我司代理费另议
参之肆、如何取得DUNS邓白氏号码?
邓白氏企业认证™ (D-U-N-S® Registered™)为全球企业提供国际通用的专属身份,企业接受邓白氏的信息收集和审核后,被授予邓白氏环球编码® (D-U-N-S Number®, ,全称Data Universal Numbering System),由邓白氏创立的9位数全球编码系统,建文件于邓白氏全球企业数据库,并安装经权威认证的邓白氏企业认证™(D-U-N-S® Registered™)电子标章。
请联系「邓白氏公司」

参之伍、完成后我会得到什么?
FDA注册完成后,会优先取得产权人识别号(Owner Number)与设备注册号(Device List Number) ,并可于FDA公开数据库中查询,而注册号(Registration Number)将由FDA内部于90天内发放。
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfRL/rl.cfm
您也许会看到坊间有各形各色的FDA证书,这些证书并非由FDA官方颁布,而是注册单位自行制作。请参阅 --- 贰、FDA注册的证书是真是假?
参之陆、谁该注册FDA医疗设备?
只要是在美国销售的医疗设备,所有关于制造、销售的业者都需注册。 例如: 制造商、代工厂、品牌商、出口商
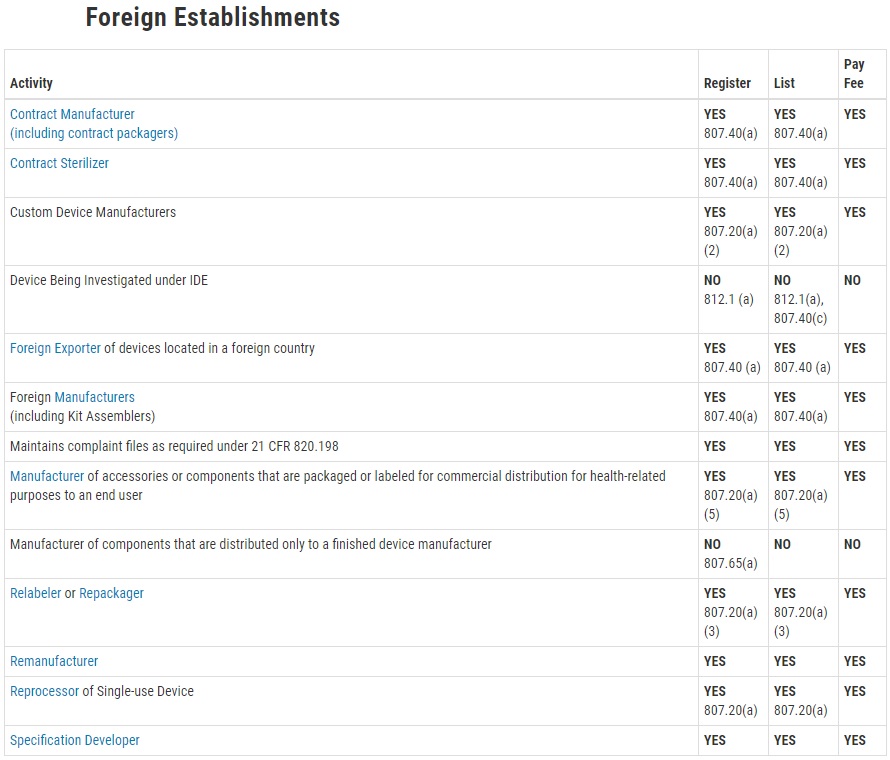
Establishments that are involved in the production and distribution of medical devices intended for commercial distribution in the United States (U.S.), including those that are imported for export only, are required to register annually with the FDA.
原文网址:
肆、 注册FDA非处方药OTC
肆之壹、我的产品算是OTC药品还是化妆品?
联邦食品、药品和化妆品法(FD&C Act)依预定使用目的,将化妆品定义为「擦、倒、喷、洒或其他等方式使用于人体之任何部位…用以清洁、美容、增进吸引力或改变外观之物品,包括保湿水、香水、唇膏、指甲油、眼睛和脸部化妆品、洗发精、烫发剂、染发剂和除臭剂,以及预定作为化妆品成份使用之任何物质。
FD&C Act 依据预定使用目的,将部份药品定义为「预定使用于诊断、治疗、减缓、处理或预防疾病或意在影响身体的结构或功能所使用的产品 (不包括食品)」,非处方药系指不须经医师处方签即可购买之药品。且该物品必须可直接使用在人体,一般常见的非处方药如:抗菌干洗手、抗菌湿纸巾、防晒乳等…
同时符合化妆品与药品可能发生于产品有两种预定使用目的时。例如,洗发精因其预定使用目的为清洁头发而被认定是化妆品;去屑配方因预定使用目的为去头皮屑而被认定为药品。因此,去屑洗发精即同时为化妆品和药品。其他如含氟牙膏、止汗香氛喷雾等…皆须同时符合药品与化妆品规定
肆之贰、我的产品可以申请OTC非处方药吗?
综上所述,若您的产品宣称疗效,如:抗菌、抗病毒、除疤、抗痘等,就属于OTC范畴;反之,若不宣称疗效,即可当作化妆品,可注册VCRP。确认产品可申请非处方药之后,就必须要判断产品的有效成分,是否有在FDA OTC Active Ingredients列表中,若成份有在列表中,并且符合对应的Monograph,即可注册为OTC非处方药。
肆之参、申请OTC要准备什么资料?
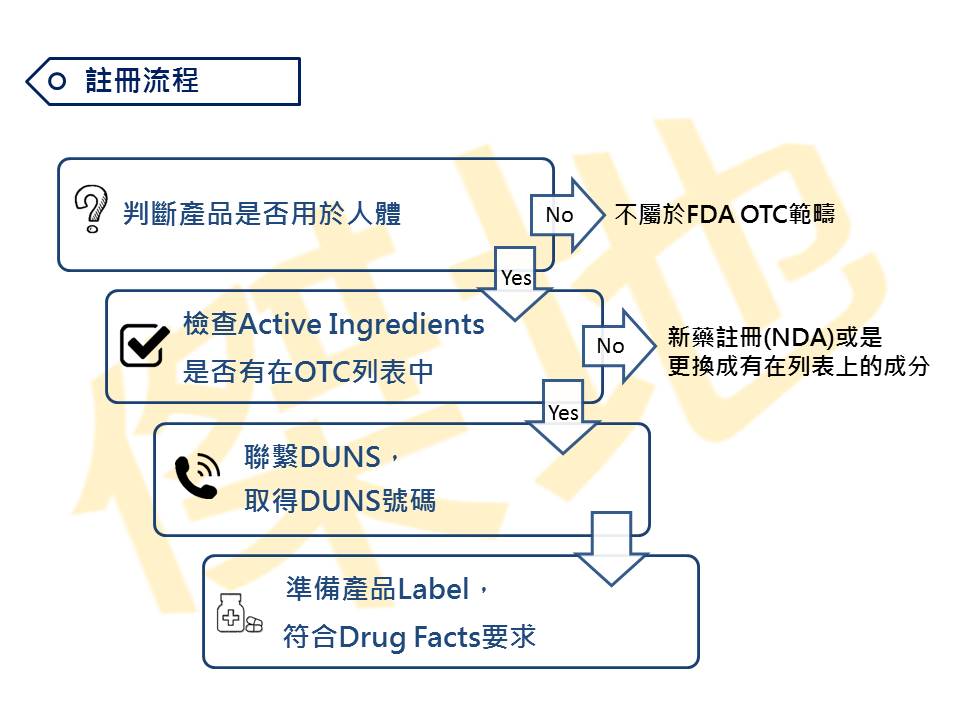
需准备的有:
1. 我司注册代理费
2. 邓白氏号码(DUNS Number)
3. 公司注册登记数据
4. 包装Label
肆之肆、申请OTC需要多少时间与费用?
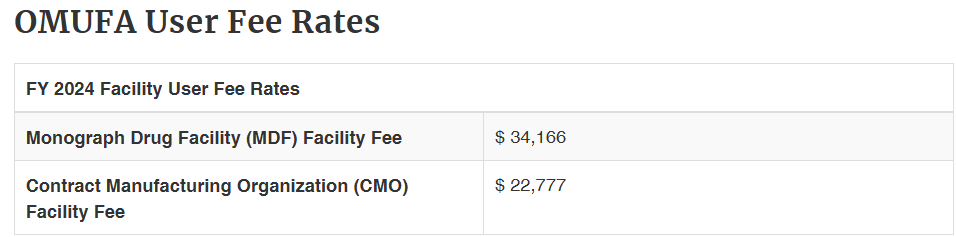
1. FDA 2024 Facility User Fee:
a. Monograph Drug Facility (MDF) Facility Fee: USD 34,166
b. Contract Manufacturing Organization (CMO) Facility Fee: USD 22,777
*CMO不能直接出货给美国的批发商、零售商或是消费者。*
2. 我司注册代理费首年USD 1,600,续约USD 1,000。
肆之伍、如何取得DUNS邓白氏号码?
邓白氏企业认证™ (D-U-N-S® Registered™)为全球企业提供国际通用的专属身份,企业接受邓白氏的信息收集和审核后,被授予邓白氏环球编码® (D-U-N-S Number®, ,全称Data Universal Numbering System),由邓白氏创立的9位数全球编码系统,建文件于邓白氏全球企业数据库,并安装经权威认证的邓白氏企业认证™(D-U-N-S® Registered™)电子标章。
请联系「邓白氏公司」

肆之陆、OTC完成后我会得到什么?
注册完成后会取得十码组成的NDC(National Drug Code),并且可于公开数据库中查询。
https://www.accessdata.fda.gov/scripts/cder/ndc/index.cfm
肆之柒、谁该注册FDA OTC非处方药?
从事制造,重新包装,重新贴标签的厂商,都必须向FDA注册。
Domestic and foreign establishments that manufacture, repack, or re-label drug products in the United States are required to register with the FDA. Domestic and foreign drug manufacturers, repackers or re-labelers are also required to list all of their commercially marketed drug products. This information helps the FDA maintain a catalog of all drugs in commercial distribution in the United States.
伍、 注册FDA食品与饮料Food and Beverages
伍之壹、申请FFR需要多少时间与费用?
1. FDA不收费。
2. 我司注册代理费首年USD 1,600,续约USD 1,000。
Food Facility Registration(FFR)为食品设施注册,若有低酸/酸化、罐头食品FCE等其他需求,请来电洽询。+886-4-25685848
伍之贰、如何取得DUNS邓白氏号码?
邓白氏企业认证™ (D-U-N-S® Registered™)为全球企业提供国际通用的专属身份,企业接受邓白氏的信息收集和审核后,被授予邓白氏环球编码® (D-U-N-S Number®, ,全称Data Universal Numbering System),由邓白氏创立的9位数全球编码系统,建文件于邓白氏全球企业数据库,并安装经权威认证的邓白氏企业认证™(D-U-N-S® Registered™)电子标章。
请联系「邓白氏公司」

伍之参、完成后我会得到什么?
注册完成后会取得Registration Number与PIN Number,FDA食品注册无公开数据库可查询。
伍之肆、什么是Prior Notice?
根据美国食品与药物管理局(Food and Drug Administration,简称 FDA)按照《生物恐怖主义法案》(Bioterrorism Act) 颁布之规定,从2003年12月12日起,任何进口到美国的人类和其他动物用食品必须事先通知FDA,除非该食品免于事先通知。
Prior Notice可以使用以下方式之任1种提交电子申请:
1. ACS of the CBP
2. FDA PNSI
透过FDA PNSI申请者,需于到达15日内提出,截止申请时间视运输之方式不同而有所差异:
陆运方式:必须在抵达前2小时完成申请。
铁路方式:必须在抵达前4小时完成申请。
空运方式:必须在抵达前4小时完成申请。
海运方式:必须在抵达前8小时完成申请。
国际包裹:必须在寄送前完成申请。
Prior Notice must be provided for all food for humans and animals that is imported or offered for import into the United States. Prior Notice must be submitted electronically through either of the following systems:
• ACS of the CBP
原文网址:
https://www.fda.gov/food/importing-food-products-united-states/filing-prior-notice-imported-foods
伍之伍、谁该注册FDA食品与饮料?
在美国销售的生产、加工、包装或储存食品、饮料、膳食补充品的所有设施,都必须在FDA注册。。
陸、 注册FDA化妆品Cosmetics
陆之壹、MoCRA简要说明
FDA已于2023/3/27停止使用VCRP,为扩大对化妆品的管理,必须遵循化现行化妆品MoCRA法案,法案中新增了不良事件报告、强制召回权、纪录保存、安全证实、遵守GMP、香料过敏原标签揭露等…
(详情请参考FDA官网:https://www.fda.gov/cosmetics/cosmetics-laws-regulations/modernization-cosmetics-regulation-act-2022-mocra)
化妆品之定义:「擦、倒、喷、洒于人体上,或以其他方式涂抹于人体上,用以清洁、美容、增进吸引力或改变外观之物品」,定义中包含的产品有:护肤霜、保湿水、香水、唇膏、指甲油、眼睛和脸部化妆品、洗发精、烫发剂、染发剂和除臭剂等,以及任何打算用作化妆品产品成分的物质。
※请注意:所有要注册MoCRA的化妆品不可提到疗效 (例如:抗痘、抗菌等…)
陆之贰、申请需多少时间与费用?
MoCRA化妆品分为1. 工厂注册与2. 产品列名。
• 申请时间:工厂注册资料齐全后(含FEI)约1周左右,产品列名视产品数量多寡而定。
• 申请费用:
1. FDA MoCRA注册目前不需缴纳FDA规费。
2. 我司注册费用欢迎加入WeChat或来信询问。
陆之参、谁该进行工厂注册与产品列名?
1. 工厂注册:生产工厂或加工厂 (每两年需更新一次)。
2. 产品列名:负责人(Responsible person)=> 化妆品产品卷标上所标示的生产工厂、包装商或经销商等 (每年需更新一次)。
陆之肆、申请MoCRA需要准备什么资料?
工厂注册:
1. FEI号码 (可由我司协助申请)
2. 工厂基本信息
产品注册:
1. 负责人(Responsible person)基本信息
2. 产品全成份CAS NO.(化学文摘社登记号码)与INCI(国际化妆品成分命名法)
FDA豁免特定小企业的注册
过去三年在美国化妆品产品的平均年度销售总额低于100万美元(根据通货膨胀调整)的负责人、设施所有者和经营者,并且不从事下述化妆品的制造或加工,应被视为小型企业,不受 MoCRA 有关良好生产规范、设施注册和产品列表的要求的约束。
上述豁免不适用于从事制造或加工以下任何产品的任何负责人或设施:
- 1. 在习惯或平常使用条件下经常接触眼睛粘膜的化妆品。
- 2. 注射的化妆品。
- 3. 供内部使用的化妆品。
- 4. 在习惯或通常使用条件下改变外观超过 24 小时且由消费者移除的化妆品不属于习惯或通常使用条件的一部分。
如果您有任何 FDA 疑问,不妨先拨个电话与我们咨询。
USA: +1‐516‐9847287
大陆: +86‐769‐88188707 / +86‐21‐58356975
台湾: +886‐4‐25685848













